| Фтор | |
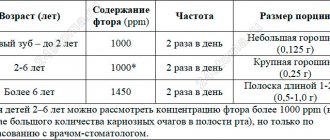
| Атомный номер | 9 |
| Внешний вид простого вещества | Фтор в сосуде Бледно-жёлтый газ, чрезвычайно химически активен. Очень ядовит. |
| Свойства атома | |
| Атомная масса (молярная масса) | 18,998403 а. е. м. (/моль) |
| Радиус атома | 71 пм |
| Энергия ионизации (первый электрон) | 1680,0 (17,41) кДж/моль () |
| Электронная конфигурация | [He] 2s2 2p5 |
| Химические свойства | |
| Ковалентный радиус | 72 пм |
| Радиус иона | (-1e)133 пм |
| Электроотрицательность (по Полингу) | 3,98 |
| Электродный потенциал | 0 |
| Степени окисления | −1 |
| Термодинамические свойства простого вещества | |
| Плотность | (при −189 °C)1,108 /³ |
| Молярная теплоёмкость | 31,34 /(·моль) |
| Теплопроводность | 0,028 /(·) |
| Температура плавления | 53,53 |
| Теплота плавления | (F-F) 0,51 кДж/моль |
| Температура кипения | 85,01 |
| Теплота испарения | 6,54 (F-F) кДж/моль |
| Молярный объём | 17,1 ³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | моноклинная |
| Параметры решётки | 5,50 b=3,28 c=7,28 β=90.0 |
| Отношение c/a | — |
| Температура Дебая | n/a |
| F | 9 |
| 18,9984 | |
| [He]2s22p5 | |
| Фтор | |
Фтор
— элемент главной подгруппы седьмой группы, второго периода периодической системы химических элементов Менделеева, с атомным номером
9
. Обозначается символом
F
Fluorum. Фтор — чрезвычайно химически активный неметалл и самый сильный окислитель, является самым лёгким элементом из группы галогенов. Простое вещество
фтор
(CAS-номер: 7782-41-4) при нормальных условиях — двухатомный газ бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор (формула F2). Очень ядовит.
История
Схема атома фтора
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту.
Как один из атомов плавиковой кислоты, элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь семьдесят шест лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (φθόρος — разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «Fluorum» (которое происходит, в свою очередь, от fluere
— «течь», по свойству соединения фтора, флюорита (CaF2), понижать температуру плавления руды и увеличивать текучесть расплава).
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание |
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека | 0,01 |
В природе значимые скопления фтора содержатся разве что только в минерале флюорите.
В некоторой степени относительно богаты фтором растения чечевица и лук
Содержанием в почве фтор обязан вулканическим газам, за счет того, что в их состав обычно входит большое количество фтороводорода.
Чем опасен переизбыток фтора в организме? Отравление фтором
Переизбыток фтора в организме может оказаться для человеческого организма гораздо большим злом, нежели его недостаток. Только 20 мг этого минерала вызывают серьёзное отравление фтором, а 2 грамма смертельны.
Острое отравление газообразным фтором вызывает поражение глаз (ожоги, конъюнктивиты, экземы век) и органов дыхания (изъязвление слизистых оболочек, потерю голоса, кровотечения из носа, бронхит, пневмонию), а также резкое нарушение кровообращения. Могут пострадать печень, сердечная мышца, вероятно развитие лейкопении, различных отклонений в работе сердечно-сосудистой и нервной систем, метаболических нарушений. При отравлении через желудочно-кишечный тракт (например ядом для мышей) начинаются судороги, резкое понижение давления, тошнота, кровавые рвота и понос, велика вероятность впадения в кому.
Хроническое отравление фтором (фторизм) также несёт серьёзную угрозу для здоровья, тем более что его диагностика затруднена. Причиной может быть чрезмерно фторированная вода (больше 4 мг/л), не утилизованные по правилам промышленные отходы, отравляющие внешнюю среду, несоблюдение техники безопасности на производстве суперфосфатов, отравление почв и растений агрохимикатами и др. Сначала зубы и дёсны становятся крайне чувствительными, затем наблюдается стирание зубов, поражение их кариесом, пародонтозы, кровотечения из носа. Поражаются бронхи, лёгкие, сердце, ЖКТ, печень, система кровообращения и сосуды… В общем, патологические изменения нарастают, как снежный ком, и затрагивают весь организм, что может при продолжении интоксикации и отсутствии лечения привести к инвалидности и преждевременной смерти.
Изотопный состав
Фтор является моноизотопным элементом, так как в природе существует только один стабильный изотоп фтора 19F. Известны еще 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18Fm. Самым долгоживущим из радиоактивных изотопов фтора является 18F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
| Изотоп | Относительная масса, а.е.м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
| 17F | 17,0020952 | 64,5 c | β+-распад в 17O | 5/2 | 4.722 |
| 18F | 18,000938 | 1,83 часа | β+-распад в 18O | 1 | |
| 19F | 18,99840322 | Стабилен | — | 1/2 | 2.629 |
| 20F | 19,9999813 | 11 c | β−-распад в 20Ne | 2 | 2.094 |
| 21F | 20,999949 | 4,2 c | β−-распад в 21Ne | 5/2 | |
| 22F | 22,00300 | 4,23 c | β−-распад в 22Ne | 4 | |
| 23F | 23,00357 | 2,2 c | β−-распад в 23Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Электронное строение
Применение метода МО для молекулы F2
Электронная конфигурация атома фтора следующая: 1s22s22p5. Атомы фтора в соединениях могут проявлять степень окисления равную −1. Положительные степени окисления в соединениях не реализуются, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — ²P3/2
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбители и 3 разрыхляющих. Очевидно, что порядок связи в молекуле равен 1.
[править] Литература
- Глоссарий терминов по химии // Й.Опейда, О.Швайка. Ин-т физико-органической химии и углехимии им. Л. М. Литвиненко НАН Украины, Донецкий национальный университет — Донецк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- Горный энциклопедический словарь: в 3 т. / Под ред. В. С. Белецкого. — Донецк: Восточный издательский дом, 2001—2004.
| Периодическая система химических элементов Д. И. Менделеева | |||||||||||||||||||||||||||||||||||||||||||
| F | |||||||||||||||||||||||||||||||||||||||||||
| Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | ||||||||||||||||||||||||||||||||||||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Суперактиноиды | Переходные металлы | Другие металлы | Полуметаллы | Другие неметаллы | Галогены | Благородные газы | Свойства неизвестны | ||||||||||||||||||||||||||||||||
Получение
Лабораторный метод получения фтора
Источником для производства фтора служит фтористый водород HF, получающийся в основном либо при действии серной кислоты H2SO4 на флюорит CaF2, либо при переработке апатитов и фосфоритов.
Лабораторный метод
Лабораторные условия — фтор можно получать с помощью химических установок. В медный сосуд 1, заполненный расплавом KF·3HF помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца (II) и глицерина.
В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:
K2MnF6 + 2SbF5 → 2KSbF6 + MnF3 + ½F2 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2 Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·3HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (редкие исключения — фторопласты), и с большинством из них — с горением и взрывом. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина:
2F2 + 2H2O → 4HF + O2
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
XeF8 → XeF6 + F2 MnF4 → MnF3 + 1/2 F2
Фтор также способен окислять кислород, образуя фторид кислорода OF2.
Свойства и особенности элементарного фтора
В Периодической системе Менделеева фтор находится во втором периоде. Атомный вес фтора 19 и атомный номер 9.
Свободный фтор — бледно-желтый газ. Запах фтора резкий и раздражающий, напоминает одновременно запах хлора и озона. По запаху можно обнаружить присутствие одной части фтора в миллионе частей воздуха. Один литр газа при 0°С и нормальном давлении весит 1,71 г.
При низкой температуре (-187°С) фтор конденсируется в жидкость канареечно-желтого цвета.
Жидкий фтор обладает высоким удельным весом. До сих пор во многих литературных источниках и учебниках фигурирует старое (заниженное) значение плотности фтора при т. кип. — 1,108 г/см3. Точное значение плотности фтора — 1,513 г/см3 (при т. кип.).
При обычной температуре, даже применяя высокое давление, фтор невозможно превратить в жидкость — вследствие низкой критической температуры (-129°С). Поэтому при конденсации и хранении фтора не пригодны способы, разработанные для хлора. При -218°С жидкий фтор замерзает в светло-желтое кристаллическое тело, которое ниже -252°С становится бесцветным.
Фтор первый член группы галогенов. По своим свойствам он во многом напоминает их, но, подобно всем первым членам групп других элементов, обнаруживает и значительные отличия. Атом фтора имеет всего два электронных слоя (n=2). Во внутреннем (К-слое) содержится два, а во внешнем (L-слое) — семь электронов. Это сообщает фтору ярко выраженные электроотрицательные свойства. Благодаря нечетному числу электронов во внешнем слое фтор особенно легко присоединяет электрон, превращаясь в отрицательный одновалентный ион.
Фтор обладает рядом особенностей, которые в известной степени объясняют своеобразные свойства его соединений. В первую очередь следует отметить малые размеры атома фтора. Так, его атомный радиус 0,64, тогда как радиус хлора равен 0,99, а радиус йода 1,33 Å. Таким образом, объем атома фтора составляет только одну четвертую часть объема атома хлора и менее одной десятой объема атома йода. Приобретая один недостающий электрон, атом фтора превращается в анион, который также отличается минимальной величиной ионного радиуса — 1,33 Å (соответствующие радиусы хлора и брома: 1,81 и 2,20 Å). Малые размеры атомов позволяют фтору плотно упаковываться вокруг атомов других элементов, в результате чего образуются соединения, богатые фтором и соответствующие высшим валентностям элементов, например: SF6, S2F10, UF6, IF7, OsF8.
Фтор обладает наибольшей реакционной способностью среди неметаллических элементов, его окислительный потенциал выше потенциала озона. Высокая электроотрицательность фтора обусловлена максимальным (по сравнению с другими элементами) сродством к электрону и очень большим потенциалом ионизации. Нормальный электродный потенциал фтора 2,85 в, тогда как для хлора и кислорода эта величина составляет 1,36 и 1,22 в. Если электроотрицательность фтора, выраженную в условных единицах, сравнить с электроотрицательностью некоторых других элементов, получается следующий ряд: фтор (4), кислород (3,5), азот и хлор (3,0), углерод (2,5), литий (1).
Причиной большой реакционной способности атомов фтора является стремление завершить октет внешнего электронного слоя, и сила этого стремления настолько велика, что фтор взаимодействует со всеми веществами за исключением некоторых инертных газов. Все реакции с участием фтора отличаются очень высоким тепловым эффектом. Например, на 1 кг эквимолекулярной смеси лития и фтора выделяется 5650 ккал, бериллия и фтора 4830, углерода и фтора 1830 ккал. При взаимодействии фтора с водородом выделяется 128,4 ккал/моль, тогда как присоединение водорода к кислороду сопровождается выделением только 57,8 ккал/моль.
С кислородом и азотом, которые наиболее близки фтору по своей электроотрицательности, он непосредственно не соединяется. Азот можно использовать как инертный разбавитель при реакциях фтора в газовой фазе. С кислородом фтор соединяется только в электрическом разряде, образуя сравнительно стабильное соединение — дифторид кислорода OF2. Поскольку фтор более электроотрицательный элемент, чем кислород, то в данном соединении атом кислорода заряжен положительно. В этом заключается резкое отличие фтора от других галогенов, образующих с кислородом неустойчивые окислы с отрицательно заряженным кислородом. И вообще во всех соединениях с кислородом фтор имеет отрицательный заряд, поэтому нельзя ожидать образования кислородных кислот фтора, аналогичных кислотам хлора, например, фторноватой HFO3 или фторной HFO4.
Фтор при комнатной и даже при пониженной температуре реагирует с бромом, кремнием, аморфным углем и некоторыми металлами. Тепловой эффект реакции настолько велик, что пламя сгорающих в среде фтора веществ по яркости напоминает кислородно-ацетиленовое пламя или пламя электросварки.
Оригинальность химического поведения фтора и часто удивительные результаты его взаимодействия с другими элементами и их соединениями в известной степени объясняются тем, что он является наиболее электроотрицательным элементом и, входя в состав молекулы, вызывает резкое изменение распределения электронной плотности. Так, введение фтора в неорганические и органические кислоты превращает «их в более сильные кислоты, чем те, которые не содержат фтора. Неорганические фториды азота (трехфтористый азот, тетрафтор гидразин и перфторамины) не обладают основными свойствами. Фтор в любых соединениях имеет отрицательную степень окисления. Только в молекулярном фторе степень окисления равна нулю. Даже в соединении с кислородом F2O фтор имеет отрицательную степень окисления.
Большая электроотрицательность фтора обусловливает возникновение водородной связи во фтористом водороде.
Особенностью молекулы фтора является малая величина энергии связи, равная 37 ккал/моль. Если сопоставить ее с энергиями связей в молекулах других галогенов, то она окажется близкой к энергии диссоциации йода:
Именно это обстоятельство наряду с большими энергиями связей, образуемых атомом фтора с другими атомами (за исключением азота и кислорода), обусловливает исключительно высокую химическую активность элементарного фтора по сравнению с другими галогенами и неметаллами.
Малая энергия связи в молекуле фтора обусловливает малую прочность молекулы, иначе говоря, -диссоциацию, часто предшествующую химическим процессам. Диссоциация может быть вызвана либо термически, либо фотохимически. Несмотря на небольшую энергию диссоциации связи F — F, необходимы весьма высокие температуры, чтобы молекула фтора заметно диссоциировала. Так, при 300°С степень диссоциации фтора составляет 0,0005, а при 500°С — 0,3%. Однако следует иметь в виду, что при чрезвычайно низкой энергии активации, потребной, например, для отщепления водорода атомами фтора, вероятно, даже такая малая степень диссоциации достаточна, чтобы вызвать в данном случае ценной процесс. Более того, если не принять мер предосторожности, вследствие выделения значительного количества тепла произойдет быстрое разветвление цепной реакции.
Большинство металлов взаимодействует с фтором при обычной температуре, но многие из них образуют стойкую защитную пленку фторида, которая препятствует дальнейшей реакции. Свинец, уран, ванадий реагируют с фтором на холоде. Натрий и кальций в этих условиях воспламеняются. При небольшом разогревании во фторе загораются титан, молибден и вольфрам. С фтором энергично взаимодействуют нагретые металлы платиновой группы. Так, осмий и рутений загораются в атмосфере фтора при 250°С, а платина и палладий — при температуре темно-красного каления.
Очень важным соединением является трехфтористая сурьма- реагент обмена галоидов на фтор. Наиболее простой способ ее получения — растворение трехокиси сурьмы во фтористоводородной кислоте. Не меньшее значение в химии фтора имеют фториды кобальта — дифторид и (мощный фторирующий агент!) трифторид. Последний получают действием фтора на дихлорид или дифторид кобальта при 150°С.
При взаимодействии элементарного фтора с другими галоидами образуются галоидофториды. Известны фториды иода, брома и хлора.
Галоидофториды очень реакционноспособные вещества. В этом отношении они приближаются к элементарному фтору. Трифторид брома, например, взрывообразно реагирует с водой, деревом, резиной и даже асбестом. Наиболее интересное свойство галоидофторидов — их сильное окислительное действие.
Наиболее реакционноспособен трифторид хлора. Он почти количественно превращает хлористое серебро во фторид двухвалентного серебра AgF2 — один из лучших фторирующих агентов. С окислами металлов трифторид хлора образует фториды высшей валентности: например, урановые соединения при реакции с ним количественно превращаются в гексафторид урана.
Алюминий, железо, хром, никель при обычной температуре образуют защитную пленку фторида. Коррозионная устойчивость деталей из этих металлов снижается с увеличением содержания в них углерода, кремния, титана и других легирующих добавок. Из стали можно изготовлять трубопроводы, используемые только при обычной температуре. Однако пленка фторида не всегда защищает металлы от фтора. Серебро и железо загораются во фторе при температуре около 500°С, но «никель, покрытый фтористым никелем, не реагирует с фтором даже при 600°С.
Нагретая вода горит в струе фтора бледно-фиолетовым пламенем, при этом образуется фтористый водород и элементарный кислород:
В этой реакции, в отличие от обычных случаев горения, кислород не причина, а продукт горения.
Перфторметан (четырехфтористый углерод) — единственное органическое вещество, которое при обычной температуре не взаимодействует с фтором. Фториды металлов, находящихся в состоянии высшей валентности, также противостоят фтору. Они менее летучи, чем соответствующие хлориды. Для неметаллов наблюдается обратная закономерность (табл. 1).
Таблица 1
Фтор имеет только один устойчивый изотоп — F19. Известны радиоактивные изотопы фтора с массами 16, 17, 18, 20, 21, но они имеют настолько короткие периоды полураспада, что практическое применение их, например в качестве меченых атомов, весьма ограничено. При кратковременных опытах, вероятно, может применяться F18, период полураспада которого 105 мин.
До недавнего времени было известно, что атомы инертных, или, как их называли ранее, благородных газов, не склонны принимать или отдавать электроны, что у них нет ни отрицательной, ни положительной валентности и что они не вступают в химические реакции; полностью укомплектованная электронная оболочка лишает эти атомы химической жизни. «Химическая пустыня» — так выглядели инертные газы, составляющие нулевую группу элементов. Но в 1962 г. в этой пустыне были обнаружены признаки жизни!
Барлетт, действуя кислородом на гексафторид платины, получил соединение PtF6O2 и показал, что оно имеет ионное строение [O2]+[PtF6]-. Он предположил, что если гексафторид платины может окислить молекулярный кислород до O+2, то он должен быть способен также превратить ксенон в Хе+, поскольку первые потенциалы ионизации молекулярного кислорода (12, 2 эв) и ксенона (12, 13 эв) практически одинаковыми действительно: при взаимодействии ксенона с гексафторидом платины, который также является газом, Барлетт получил оранжево-желтое твердое вещество, которому было приписано тоже ионное строение [Xe]+[PtF6]. Это вещество сублимируется в вакууме и гидролизуется водой до ксенона, кислорода, фтористого водорода и двуокиси платины. Оказалось, что сравнительно несложными операциями можно осуществить непосредственную реакцию между фтором и инертными газами. Заповедные вещества, которые с молчаливого согласия химиков оставались нетронутыми в течение многих десятилетий, вскоре сделались объектом многочисленных исследований. Достаточно сказать, что за пять лет после работ Барлетта было опубликовано несколько сот исследований, посвященных химии «инертных» газов.
Действуя ксеноном на фтор при 400°С, исследователи получили четырехфтористый ксенон XeF4, представляющий собой бесцветные кристаллы. Это вещество устойчиво при комнатной температуре и плавится около 100°С. Были получены также фторид и гаксафторид ксенона, соединения криптона и радона (KrF4 и RnFx.) и такие вещества, как XeRnF6, XeF2(SbF5).
Тетрафторид и гексафторид ксенона гидролизуются в воде, образуя водные растворы ХеО3. Растворы эти устойчивы, обладают сильным окислительным действием. Описаны соли ксеноновой кислоты — перксенаты: Na4XeO6•2,2H2O, Ba2Xeo6•1,5H2O и др.
Водные растворы перксената натрия медленно выделяют кислород, образуя элементарный ксенон. Многие из соединений ксенона стабильны при обычной температуре, но XeO3, представляющий собой твердое белое вещество, взрывается в вакууме при нагревании до 40°С. Особенностью этих соединений является совмещение в одной молекуле сильно электроотрицательных атомов кислорода и фтора и атомов наиболее тяжелых инертных газов. Легкие инертные газы — гелий и неон, у которых внешние электроны связаны более прочно, не реагируют так легко, хотя не исключено, что некоторые их соединения могут быть получены. Вероятно, химия легких инертных газов будет еще более своеобразной, а методы их получения окажутся не менее оригинальными.
Таким образом, оказалась развенчанной легенда о полной инертности элементов нулевой группы, недавно казавшаяся аксиомой, и подтверждена способность фтора давать соединения со всеми элементами.
Применение в химической деятельности (химической промышленноси)
Газообразный фтор используется для получения:
гексафторида урана UF6 из UF4, применяемого для разделения изотопов урана для ядерной промышленности. трёхфтористого хлора ClF3 — фторирующий агент и мощный окислитель ракетного топлива шестифтористой серы SF6 — газообразный изолятор в электротехнической промышленности фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами фреонов — хороших хладагентов тефлонов — химически инертных полимеров гексафтороалюмината натрия — для последующего получения алюминия электролизом различных соединений фтора
Ракетная техника
Соединения фтора широко применяются в ракетной технике как окислитель ракетного топлива.
Применение в медицине
Соединения фтора широко применяются в медицине как кровезаменители.
Применение
Значит. часть cвободного Ф. идёт на получение разнообразных фторсодержащих материалов (электролитов, растворителей, лаков, ПАВ, смазочных жидкостей, инсектицидов, пестицидов, заменителей крови, фармацевтич. препаратов и др.). Ф. используют в произ-ве гексафторида урана UF6, трифторида бора BF3, фторидов графита CFn и др. элементов (WF6, NF3, SF6, CF4, SbF5, XeF6 и др.). Применяют в эксимерных лазерах на ArF* или KrF*.
Ф. высокотоксичен. Раздражает кожу, слизистые оболочки носа и глаз; вызывает дерматиты, ожоги кожи, конъюнктивиты, отёк лёгких.
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариеса и флюорозу (крапчатости эмали) и остеосаркомы, соответственно.
Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фтора или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50 %.
Предельно допустимая концентрация связанного фторав воздухе промышленных помещениях равен 0,0005 мг/литр.
Как выражается дефицит фтора в организме?
Причинами дефицита фтора в организме могут быть нарушения метаболизма, не позволяющие усваиваться ему в нужных количествах, и недостаточное поступление его извне. Во втором случае, как правило, речь идёт о бедной фтором питьевой воде (менее 0,7 мг/л).
Характерные симптомы нехватки фтора – это поражение зубов кариесом, их хрупкость, а также развитие остеопороза. Ногти и волосы также становятся ломкими, плохо растут. Вследствие уменьшения содержания в организме железа, которое плохо усваивается без фтора, может возникнуть анемия.
Дополнительная информация
Фториды Соединения фтора в ракетной технике Соединения фтора в медицине Категория:Соединения фтора
Фтор, Fluorum, F(9)
Фтор (Fluorine, франц. и нем. Fluor) получен в свободном состоянии в 1886 г., но его соединения известны давно и широко применялись в металлургии и производстве стекла. Первые упоминания о флюорите (СаР,) под названием плавиковый шпат (Fliisspat) относятся к XVI в. В одном из сочинений, приписываемых легендарному Василию Валентину, упоминаются окрашенные в различные цвета камни — флюссе (Fliisse от лат. fluere — течь, литься), которые применялись в качестве плавней при выплавке металлов. Об этом же пишут Агрикола и Либавиус. Последний вводит особые названия для этого плавня — плавиковый шпат (Flusspat) и минеральный плавик. Многие авторы химико-технических сочинений XVII и XVIII вв. описывают разные виды плавикого шпата. В России эти камни именовались плавик, спалт, спат; Ломоносов относил эти камни к разряду селенитов и называл шпатом или флусом (флус хрустальный). Русские мастера, а также собиратели коллекций минералов (например, в XVIII в. князь П. Ф. Голицын) знали, что некоторые виды шпатов при нагревании (например, в горячей воде) светятся в темноте. Впрочем, еще Лейбниц в своей истории фосфора (1710) упоминает в связи с этим о термофосфоре (Thermophosphorus).
По-видимому, химики и химики-ремесленники познакомились с плавиковой кислотой не позднее XVII в. В 1670 г. нюрнбергский ремесленник Шванхард использовал плавиковый шпат в смеси с серной кислотой для вытравливания узоров на стеклянных бокалах. Однако в то время природа плавикового шпата и плавиковой кислоты была совершенно неизвестна. Полагали, например, что протравливающее действие в процессе Шванхарда оказывает кремневая кислота. Это ошибочное мнение устранил Шееле, доказав, что при взаимодействии плавикового шпата с серной кислотой кремневая кислота получается в результате разъедания стеклянной реторты образующейся плавиковой кислотой. Кроме того, Шееле установил (1771), что плавиковый шпат представляет собой соединение известковой земли с особой кислотой, которая получила название «Шведская кислота».
Лавуазье признал радикал плавиковой кислоты (radical fluorique) простым телом и включил его в свою таблицу простых тел. В более или менее чистом виде плавиковая кислота была получена в 1809 r. Гей-Люссаком и Тенаром путем перегонки плавикового шпата с серной кислотой в свинцовой или серебряной реторте. При этой операции оба исследователя получили отравление. Истинную природу плавиковой кислоты установил в 1810 г. Ампер. Он отверг мнение Лавуазье о том, что в плавиковой кислоте должен содержаться кислород, и доказал аналогию этой кислоты с хлористоводородной кислотой. О своих выводах Ампер сообщил Дэви, который незадолго до этого установил элементарную природу хлора. Дэви полностью согласился с доводами Ампера и затратил немало усилий на получение свободного фтора электролизом плавиковой кислоты и другими путями. Принимая во внимание сильное разъедающее действие плавиковой кислоты на стекло, а также на растительные и животные ткани, Ампер предложил назвать элемент, содержащийся в ней, фтором (греч.- разрушение, гибель, мор, чума и т. д.). Однако Дэви не принял этого названия и предложил другое — флюорин (Fluorine) по аналогии с тогдашним названием хлора — хлорин (Chlorine), оба названия до сих пор употребляются в английском языке. В русском языке сохранилось название, данное Ампером.
Многочисленные попытки выделить свободный фтор в XIX в. не привели к успешным результатам. Лишь в 1886 г. Муассану удалось сделать это и получить свободный фтор в виде газа желто-зеленого цвета. Так как фтор является необычайно агрессивным газом, Муассану пришлось преодолеть множество затруднений, прежде чем он нашел материал, пригодный для аппаратуры в опытах со фтором. U-образная трубка для электролиза фтористо- водородной кислоты при 55°С (охлаждаемая жидким хлористым метилом) была сделана из платины с пробками из плавикового шпата. После того как были исследованы химические и физические свойства свободного фтора, он нашел широкое применение. Сейчас фтор — один из важнейших компонентов синтеза фторорганических веществ широкого ассортимента. В русской литературе начала XIX в. фтор именовался по-разному: основание плавиковой кислоты, флуорин (Двигубский,1824), плавиковость (Иовский), флюор (Щеглов, 1830), флуор, плавик, плавикотвор. Гесс с 1831 г. ввел в употребление название фтор.
Отрывок, характеризующий Фтор
Если цель русских состояла в том, чтобы отрезать и взять в плен Наполеона и маршалов, и цель эта не только не была достигнута, и все попытки к достижению этой цели всякий раз были разрушены самым постыдным образом, то последний период кампании совершенно справедливо представляется французами рядом побед и совершенно несправедливо представляется русскими историками победоносным. Русские военные историки, настолько, насколько для них обязательна логика, невольно приходят к этому заключению и, несмотря на лирические воззвания о мужестве и преданности и т. д., должны невольно признаться, что отступление французов из Москвы есть ряд побед Наполеона и поражений Кутузова. Но, оставив совершенно в стороне народное самолюбие, чувствуется, что заключение это само в себе заключает противуречие, так как ряд побед французов привел их к совершенному уничтожению, а ряд поражений русских привел их к полному уничтожению врага и очищению своего отечества. Источник этого противуречия лежит в том, что историками, изучающими события по письмам государей и генералов, по реляциям, рапортам, планам и т. п., предположена ложная, никогда не существовавшая цель последнего периода войны 1812 года, – цель, будто бы состоявшая в том, чтобы отрезать и поймать Наполеона с маршалами и армией. Цели этой никогда не было и не могло быть, потому что она не имела смысла, и достижение ее было совершенно невозможно. Цель эта не имела никакого смысла, во первых, потому, что расстроенная армия Наполеона со всей возможной быстротой бежала из России, то есть исполняла то самое, что мог желать всякий русский. Для чего же было делать различные операции над французами, которые бежали так быстро, как только они могли? Во вторых, бессмысленно было становиться на дороге людей, всю свою энергию направивших на бегство. В третьих, бессмысленно было терять свои войска для уничтожения французских армий, уничтожавшихся без внешних причин в такой прогрессии, что без всякого загораживания пути они не могли перевести через границу больше того, что они перевели в декабре месяце, то есть одну сотую всего войска. В четвертых, бессмысленно было желание взять в плен императора, королей, герцогов – людей, плен которых в высшей степени затруднил бы действия русских, как то признавали самые искусные дипломаты того времени (J. Maistre и другие). Еще бессмысленнее было желание взять корпуса французов, когда свои войска растаяли наполовину до Красного, а к корпусам пленных надо было отделять дивизии конвоя, и когда свои солдаты не всегда получали полный провиант и забранные уже пленные мерли с голода. Весь глубокомысленный план о том, чтобы отрезать и поймать Наполеона с армией, был подобен тому плану огородника, который, выгоняя из огорода потоптавшую его гряды скотину, забежал бы к воротам и стал бы по голове бить эту скотину. Одно, что можно бы было сказать в оправдание огородника, было бы то, что он очень рассердился. Но это нельзя было даже сказать про составителей проекта, потому что не они пострадали от потоптанных гряд. Но, кроме того, что отрезывание Наполеона с армией было бессмысленно, оно было невозможно. Невозможно это было, во первых, потому что, так как из опыта видно, что движение колонн на пяти верстах в одном сражении никогда не совпадает с планами, то вероятность того, чтобы Чичагов, Кутузов и Витгенштейн сошлись вовремя в назначенное место, была столь ничтожна, что она равнялась невозможности, как то и думал Кутузов, еще при получении плана сказавший, что диверсии на большие расстояния не приносят желаемых результатов. Во вторых, невозможно было потому, что, для того чтобы парализировать ту силу инерции, с которой двигалось назад войско Наполеона, надо было без сравнения большие войска, чем те, которые имели русские. В третьих, невозможно это было потому, что военное слово отрезать не имеет никакого смысла. Отрезать можно кусок хлеба, но не армию. Отрезать армию – перегородить ей дорогу – никак нельзя, ибо места кругом всегда много, где можно обойти, и есть ночь, во время которой ничего не видно, в чем могли бы убедиться военные ученые хоть из примеров Красного и Березины. Взять же в плен никак нельзя без того, чтобы тот, кого берут в плен, на это не согласился, как нельзя поймать ласточку, хотя и можно взять ее, когда она сядет на руку. Взять в плен можно того, кто сдается, как немцы, по правилам стратегии и тактики. Но французские войска совершенно справедливо не находили этого удобным, так как одинаковая голодная и холодная смерть ожидала их на бегстве и в плену. В четвертых же, и главное, это было невозможно потому, что никогда, с тех пор как существует мир, не было войны при тех страшных условиях, при которых она происходила в 1812 году, и русские войска в преследовании французов напрягли все свои силы и не могли сделать большего, не уничтожившись сами. В движении русской армии от Тарутина до Красного выбыло пятьдесят тысяч больными и отсталыми, то есть число, равное населению большого губернского города. Половина людей выбыла из армии без сражений. И об этом то периоде кампании, когда войска без сапог и шуб, с неполным провиантом, без водки, по месяцам ночуют в снегу и при пятнадцати градусах мороза; когда дня только семь и восемь часов, а остальное ночь, во время которой не может быть влияния дисциплины; когда, не так как в сраженье, на несколько часов только люди вводятся в область смерти, где уже нет дисциплины, а когда люди по месяцам живут, всякую минуту борясь с смертью от голода и холода; когда в месяц погибает половина армии, – об этом то периоде кампании нам рассказывают историки, как Милорадович должен был сделать фланговый марш туда то, а Тормасов туда то и как Чичагов должен был передвинуться туда то (передвинуться выше колена в снегу), и как тот опрокинул и отрезал, и т. д., и т. д. Русские, умиравшие наполовину, сделали все, что можно сделать и должно было сделать для достижения достойной народа цели, и не виноваты в том, что другие русские люди, сидевшие в теплых комнатах, предполагали сделать то, что было невозможно. Все это странное, непонятное теперь противоречие факта с описанием истории происходит только оттого, что историки, писавшие об этом событии, писали историю прекрасных чувств и слов разных генералов, а не историю событий. Для них кажутся очень занимательны слова Милорадовича, награды, которые получил тот и этот генерал, и их предположения; а вопрос о тех пятидесяти тысячах, которые остались по госпиталям и могилам, даже не интересует их, потому что не подлежит их изучению. А между тем стоит только отвернуться от изучения рапортов и генеральных планов, а вникнуть в движение тех сотен тысяч людей, принимавших прямое, непосредственное участие в событии, и все, казавшиеся прежде неразрешимыми, вопросы вдруг с необыкновенной легкостью и простотой получают несомненное разрешение. Цель отрезывания Наполеона с армией никогда не существовала, кроме как в воображении десятка людей. Она не могла существовать, потому что она была бессмысленна, и достижение ее было невозможно. Цель народа была одна: очистить свою землю от нашествия. Цель эта достигалась, во первых, сама собою, так как французы бежали, и потому следовало только не останавливать это движение. Во вторых, цель эта достигалась действиями народной войны, уничтожавшей французов, и, в третьих, тем, что большая русская армия шла следом за французами, готовая употребить силу в случае остановки движения французов. Русская армия должна была действовать, как кнут на бегущее животное. И опытный погонщик знал, что самое выгодное держать кнут поднятым, угрожая им, а не по голове стегать бегущее животное. Когда человек видит умирающее животное, ужас охватывает его: то, что есть он сам, – сущность его, в его глазах очевидно уничтожается – перестает быть. Но когда умирающее есть человек, и человек любимый – ощущаемый, тогда, кроме ужаса перед уничтожением жизни, чувствуется разрыв и духовная рана, которая, так же как и рана физическая, иногда убивает, иногда залечивается, но всегда болит и боится внешнего раздражающего прикосновения. После смерти князя Андрея Наташа и княжна Марья одинаково чувствовали это. Они, нравственно согнувшись и зажмурившись от грозного, нависшего над ними облака смерти, не смели взглянуть в лицо жизни. Они осторожно берегли свои открытые раны от оскорбительных, болезненных прикосновений. Все: быстро проехавший экипаж по улице, напоминание об обеде, вопрос девушки о платье, которое надо приготовить; еще хуже, слово неискреннего, слабого участия болезненно раздражало рану, казалось оскорблением и нарушало ту необходимую тишину, в которой они обе старались прислушиваться к незамолкшему еще в их воображении страшному, строгому хору, и мешало вглядываться в те таинственные бесконечные дали, которые на мгновение открылись перед ними. Только вдвоем им было не оскорбительно и не больно. Они мало говорили между собой. Ежели они говорили, то о самых незначительных предметах. И та и другая одинаково избегали упоминания о чем нибудь, имеющем отношение к будущему. Признавать возможность будущего казалось им оскорблением его памяти. Еще осторожнее они обходили в своих разговорах все то, что могло иметь отношение к умершему. Им казалось, что то, что они пережили и перечувствовали, не могло быть выражено словами. Им казалось, что всякое упоминание словами о подробностях его жизни нарушало величие и святыню совершившегося в их глазах таинства. Беспрестанные воздержания речи, постоянное старательное обхождение всего того, что могло навести на слово о нем: эти остановки с разных сторон на границе того, чего нельзя было говорить, еще чище и яснее выставляли перед их воображением то, что они чувствовали. Но чистая, полная печаль так же невозможна, как чистая и полная радость. Княжна Марья, по своему положению одной независимой хозяйки своей судьбы, опекунши и воспитательницы племянника, первая была вызвана жизнью из того мира печали, в котором она жила первые две недели. Она получила письма от родных, на которые надо было отвечать; комната, в которую поместили Николеньку, была сыра, и он стал кашлять. Алпатыч приехал в Ярославль с отчетами о делах и с предложениями и советами переехать в Москву в Вздвиженский дом, который остался цел и требовал только небольших починок. Жизнь не останавливалась, и надо было жить. Как ни тяжело было княжне Марье выйти из того мира уединенного созерцания, в котором она жила до сих пор, как ни жалко и как будто совестно было покинуть Наташу одну, – заботы жизни требовали ее участия, и она невольно отдалась им. Она поверяла счеты с Алпатычем, советовалась с Десалем о племяннике и делала распоряжения и приготовления для своего переезда в Москву. Наташа оставалась одна и с тех пор, как княжна Марья стала заниматься приготовлениями к отъезду, избегала и ее. Княжна Марья предложила графине отпустить с собой Наташу в Москву, и мать и отец радостно согласились на это предложение, с каждым днем замечая упадок физических сил дочери и полагая для нее полезным и перемену места, и помощь московских врачей. – Я никуда не поеду, – отвечала Наташа, когда ей сделали это предложение, – только, пожалуйста, оставьте меня, – сказала она и выбежала из комнаты, с трудом удерживая слезы не столько горя, сколько досады и озлобления. После того как она почувствовала себя покинутой княжной Марьей и одинокой в своем горе, Наташа большую часть времени, одна в своей комнате, сидела с ногами в углу дивана, и, что нибудь разрывая или переминая своими тонкими, напряженными пальцами, упорным, неподвижным взглядом смотрела на то, на чем останавливались глаза. Уединение это изнуряло, мучило ее; но оно было для нее необходимо. Как только кто нибудь входил к ней, она быстро вставала, изменяла положение и выражение взгляда и бралась за книгу или шитье, очевидно с нетерпением ожидая ухода того, кто помешал ей. Ей все казалось, что она вот вот сейчас поймет, проникнет то, на что с страшным, непосильным ей вопросом устремлен был ее душевный взгляд. В конце декабря, в черном шерстяном платье, с небрежно связанной пучком косой, худая и бледная, Наташа сидела с ногами в углу дивана, напряженно комкая и распуская концы пояса, и смотрела на угол двери. Она смотрела туда, куда ушел он, на ту сторону жизни. И та сторона жизни, о которой она прежде никогда не думала, которая прежде ей казалась такою далекою, невероятною, теперь была ей ближе и роднее, понятнее, чем эта сторона жизни, в которой все было или пустота и разрушение, или страдание и оскорбление. Она смотрела туда, где она знала, что был он; но она не могла его видеть иначе, как таким, каким он был здесь. Она видела его опять таким же, каким он был в Мытищах, у Троицы, в Ярославле. Она видела его лицо, слышала его голос и повторяла его слова и свои слова, сказанные ему, и иногда придумывала за себя и за него новые слова, которые тогда могли бы быть сказаны. Вот он лежит на кресле в своей бархатной шубке, облокотив голову на худую, бледную руку. Грудь его страшно низка и плечи подняты. Губы твердо сжаты, глаза блестят, и на бледном лбу вспрыгивает и исчезает морщина. Одна нога его чуть заметно быстро дрожит. Наташа знает, что он борется с мучительной болью. «Что такое эта боль? Зачем боль? Что он чувствует? Как у него болит!» – думает Наташа. Он заметил ее вниманье, поднял глаза и, не улыбаясь, стал говорить. «Одно ужасно, – сказал он, – это связать себя навеки с страдающим человеком. Это вечное мученье». И он испытующим взглядом – Наташа видела теперь этот взгляд – посмотрел на нее. Наташа, как и всегда, ответила тогда прежде, чем успела подумать о том, что она отвечает; она сказала: «Это не может так продолжаться, этого не будет, вы будете здоровы – совсем». Она теперь сначала видела его и переживала теперь все то, что она чувствовала тогда. Она вспомнила продолжительный, грустный, строгий взгляд его при этих словах и поняла значение упрека и отчаяния этого продолжительного взгляда. «Я согласилась, – говорила себе теперь Наташа, – что было бы ужасно, если б он остался всегда страдающим. Я сказала это тогда так только потому, что для него это было бы ужасно, а он понял это иначе. Он подумал, что это для меня ужасно бы было. Он тогда еще хотел жить – боялся смерти. И я так грубо, глупо сказала ему. Я не думала этого. Я думала совсем другое. Если бы я сказала то, что думала, я бы сказала: пускай бы он умирал, все время умирал бы перед моими глазами, я была бы счастлива в сравнении с тем, что я теперь. Теперь… Ничего, никого нет. Знал ли он это? Нет. Не знал и никогда не узнает. И теперь никогда, никогда уже нельзя поправить этого». И опять он говорил ей те же слова, но теперь в воображении своем Наташа отвечала ему иначе. Она останавливала его и говорила: «Ужасно для вас, но не для меня. Вы знайте, что мне без вас нет ничего в жизни, и страдать с вами для меня лучшее счастие». И он брал ее руку и жал ее так, как он жал ее в тот страшный вечер, за четыре дня перед смертью. И в воображении своем она говорила ему еще другие нежные, любовные речи, которые она могла бы сказать тогда, которые она говорила теперь. «Я люблю тебя… тебя… люблю, люблю…» – говорила она, судорожно сжимая руки, стискивая зубы с ожесточенным усилием.